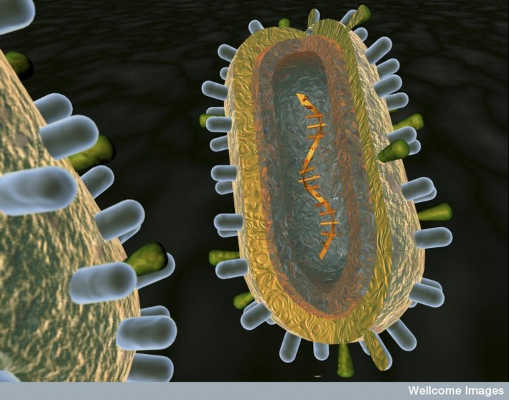
 ترجمة فنان لتشريح فيروس. آنا Tanczos / ويلكم صور, CC BY-NC-ND
ترجمة فنان لتشريح فيروس. آنا Tanczos / ويلكم صور, CC BY-NC-ND
لا أحد يريد أن يصاب بالأنفلونزا ، وأفضل خط دفاع هو لقاح الأنفلونزا الموسمية. لكن إنتاج لقاح إنفلونزا سنوي فعال يعتمد على التنبؤ الدقيق بأنواع سلالات الأنفلونزا التي من المرجح أن تصيب السكان في أي موسم معين. يتطلب الأمر تنسيق العديد من المراكز الصحية حول العالم مع انتقال الفيروس من منطقة إلى أخرى. حالما يستقر علماء الأوبئة على سلالات الإنفلونزا المستهدفة ، يتحول إنتاج اللقاحات إلى معدات عالية ؛ تستغرق ما يقرب من ستة أشهر لتوليد أكثر من 150 مليون جرعة قابلة للحقن ضروري للسكان الأمريكيين.
إلى أي مدى يعمل لقاح الإنفلونزا السنوي؟
يعتمد إنتاج طلقة أنفلونزا سنوية فعالة على التنبؤ بدقة بأن سلالات الإنفلونزا الأكثر احتمالية لإصابة السكان في موسم معين. تجري مراكز السيطرة على الأمراض (CDC) دراسات قائمة على الملاحظة كل عام لحساب "فعالية اللقاح" في تصوير هذه السنة.
قد يكون للتنبؤ الوبائي غير السليم أو غير الكامل عواقب وخيمة. في 2009 ، بينما الشركات المصنعة ، بما في ذلك MedImmune و Sanofi Pasteurكانوا يستعدون لقاحات ضد السلالات المتوقعة سلالة إنفلونزا إضافية ، H1N1، ظهرت. لم يحمي اللقاح المحضر ضد هذه السلالة غير المتوقعة ، مما تسبب في حدوث حالة من الذعر في جميع أنحاء العالم وتأكيد وفاة 18,000 - على الأرجح مجرد جزء بسيط من العدد الحقيقي ، يقدر أن يتجاوز 150,000. متأخرا بشكل أفضل من عدمه ، أنتج اللقاح في النهاية ضد H1N1 ، مما يتطلب إطلاق طلقة أنفلونزا ثانية في ذلك العام.
نظرا لأن الأنفلونزا قد تسببت في غالبية الأوبئة على مدى السنوات الماضية 100 - بما في ذلك أنفلونزا 1918 ذلك أسفرت عن عدد من الوفيات 50 مليون - لقد تركنا مع السؤال: هل يمكن للعلماء إنتاج لقاح "عالمي" قادر على الحماية ضد سلالات مختلفة من الأنفلونزا ، لا تتطلب تنبؤات سنوية من قبل علماء الأوبئة وتصوير سنوي بالنسبة لك؟
تؤدي اللقاحات إلى تقوية جهاز المناعة للقتال
في القرن 18th ، ويمكن القول في وقت سابق من ذلك بكثير في التاريخ ، كان من المعروف أن أ الناجي من الجدري لن ينزل معها مرة أخرى عند التعرض اللاحق. بطريقة ما ، أعطت العدوى مناعة ضد المرض. واعترف الناس بأن حليب الأبقار التي تلامست مع الماشية التي تعاني من جدر الجدري ستتم حمايتها بالمثل من الجدري.
في أواخر 1700s ، مزارع بنيامين جيستي لقحت عائلته مع جدري البقر، تحصينها بشكل فعال ضد الجدري ، على الرغم من التعرض في المستقبل. الطبيب المعالج بعد ذلك قام إدوارد جينر بتحويل البشرية إلى عصر جديد من علم المناعة عندما قدم المصداقية العلمية لهذا الإجراء.
لذا ، إذا كان أحد اللقاحات التي تُصاب بجدري البقر أو أحد أنواع التعرض للجدري (والبقاء على قيد الحياة) يكتسب مناعة أو حتى مناعة مدى الحياة ، فلماذا يتم تشجيع الأفراد على تلقي لقاح الإنفلونزا كل عام؟
تكمن الإجابة في مدى سرعة تغير تشريح فيروس الأنفلونزا. يتكون كل فيروس من غشاء كروي تقريبًا مغلفًا للمواد الوراثية المتحورة باستمرار. ويمتلئ هذا الغشاء بنوعين من "المسامير" وهما: الهيماغلوتينين ، أو HA ، والنورامينيداز ، أو NA ، كل منهما يتكون من ساق ورأس. يساعد HA و NA الفيروس المسبب للعدوى عن طريق الارتباط بالخلايا المضيفة ، والتوسط في دخول الفيروس إلى الخلية وفي النهاية الخروج منه.
تفرز اللقاحات عادة الأجسام المضادة التي تستهدف هذين الجزئين. بمجرد حقنها ، يبدأ جهاز المناعة لدى الفرد بالعمل. تجمع الخلايا المتخصصة جزيئات اللقاحات كغازات ؛ ثم تقوم خلايا أخرى بتوليد أجسام مضادة تتعرف على الجزيئات الأجنبية. في المرة التالية التي يظهر فيها هؤلاء الغزاة أنفسهم - سواء كانوا على شكل نفس اللقاح أو سلالات الفيروس التي تحاكيها - تتعرف خلايا المناعة في الجسم على هذه الخلايا وتقاومها ، مما يمنع العدوى.
بالنسبة لمطوري اللقاحات ، فإن إحدى الخصائص المحبطة للجينوم المتحور للإنفلونزا هي مدى سرعة تغير HA و NA. هذه التعديلات المستمرة هي ما يعيدهم إلى لوحة الرسم لقاحات جديدة كل موسم للإنفلونزا.
طرق مختلفة لتصميم لقاح
كان لقاح الجدري أول من استخدم "النموذج التجريبي" لقياس اللقاحات - وهو نفس الاستراتيجية التي نستخدمها اليوم بشكل كبير. وهو يعتمد على نهج التجربة والخطأ لتقليد المناعة التي تسببها العدوى الطبيعية.
وبعبارة أخرى ، يعتقد مطورو اللقاح أن الجسم سيصيب استجابة الجسم المضاد بشيء في التلقيح. لكنها لا تركز على أي رقعة محددة من الفيروس تتسبب في استجابة مناعية. لا يهم حقا إذا كان رد فعل على رقعة صغيرة من HA التي تشترك فيها العديد من السلالات ، على سبيل المثال. عند استخدام فيروس كامل كمواد انطلاق ، من الممكن الحصول على العديد من الأجسام المضادة المختلفة التي تتعرف على أجزاء مختلفة من الفيروس المستخدم في اللقاح.
تتناسب لقطة الإنفلونزا الموسمية بشكل عام مع هذا المنهج التجريبي. في كل عام ، يتنبأ علماء الأوبئة بأن سلالات الإنفلونزا هي على الأرجح تصيب السكان ، وعادة ما تستقر على ثلاثة أو أربعة. ثم يضعف الباحثون هذه السلالات أو يعطلونها حتى يتمكنوا من العمل كمحاكاة في لقاح الأنفلونزا لهذا العام دون أن يعطوا إنفلونزا كاملة. والأمل هو أن يستجيب جهاز مناعة الفرد للقاح عن طريق تكوين أجسام مضادة تستهدف هذه السلالات ؛ ثم عندما يكون هو أو هي على اتصال مع الانفلونزا ، سوف تنتظر الأجسام المضادة لتحييد تلك السلالات.
لكن هناك طريقة مختلفة لتصميم اللقاح. يطلق عليه تصميم عقلاني ويمثل تحولًا محتملًا في تغيير نمط اللعبة في علم اللقاحات.
والهدف هو تصميم بعض الجزيئات - أو "المستمنع" - التي يمكن أن تتسبب في إنتاج أجسام مضادة فعالة دون الحاجة إلى التعرض للفيروس. بالنسبة إلى اللقاحات الحالية ، قد تسمح المناعية المهندسة باستجابات أكثر تحديدًا ، بمعنى أن الاستجابة المناعية تستهدف أجزاء معينة من الفيروس ، واتساعًا أكبر ، بمعنى أنها قد تستهدف سلالات متعددة أو حتى فيروسات ذات صلة.
تعمل هذه الاستراتيجية على استهداف حلقات لاصقة معينة أو بقع من الفيروس. وبما أن الأجسام المضادة تعمل من خلال التعرف على الهياكل ، فإن المصممين يريدون التأكيد على النظام المناعي للخصائص الهيكلية للمناعة المناعية التي أنشأوها. ثم يمكن للباحثين أن يحاولوا تصميم اللقاحات المرشحة بتلك البنى على أمل أن يحثوا جهاز المناعة على إنتاج أجسام مضادة ذات صلة. قد يسمح لهم هذا المسار بتجميع لقاح يستثير استجابة مناعية أكثر فعالية وكفاءة من الممكن باستخدام طريقة التجربة والخطأ التقليدية.
وقد أحرز تقدم واعد في تصميم لقاح للفيروس المخلوي التنفسي باستخدام هذا النموذج العقلاني الجديد ، ولكن الجهود لا تزال جارية لاستخدام هذا النهج للإنفلونزا.
نحو لقاح عالمي الانفلونزا
في السنوات الأخيرة ، قام الباحثون بعزل عدد من الأجسام المضادة القوية والمضادة للأجسام المضادة المنتجة في أجسامنا. في حين أن استجابة الأضداد للأنفلونزا هي موجهة في المقام الأول على رأس ارتفاع HA، تم العثور على عدة ذلك الهدف الجذع ها. بما أن الجذع أكثر ثباتًا عبر السلالات الفيروسية من الرأس ، فقد يكون هذا هو كعب أخيل الأنفلونزا ، والأجسام المضادة التي تستهدف هذه المنطقة قد تكون نموذجًا جيدًا لتصميم اللقاح.
يتابع الباحثون عددًا من الطرق التي يمكن أن تجعل الجسم ينتج هذه الأجسام المضادة ذات الأهمية قبل أن يصاب بالعدوى. استراتيجية واحدة ، تعرف باسم عرض جسيمات متناهية الصغر ، تتضمن تصميم جزيء يحتوي على جزء من الفيروس. في المختبر ، يمكن أن يربط العلماء بين مجموعة من جسيمات HA و NA في الجزء الخارجي من جسيمات نانوية كروية تكون قادرة بحد ذاتها على التسبب في استجابة مناعية. عندما يحقن الجهاز المناعي كجزء من اللقاح ، يمكنه أن "يرى" هذه الجزيئات ، وأن ينتج الحظ مع الأجسام المضادة ضده.
أحد الأسئلة الرئيسية التي تحتاج إلى إجابة هو ما يجب أن يظهر بالضبط على السطح الخارجي لهذه الجسيمات النانوية. تعرض بعض الاستراتيجيات نسخًا مختلفة من جزيئات HA الكاملة ، في حين تحتوي غيرها على السيقان. في حين أن هناك حاجة لجمع المزيد من البيانات حول البشر للتحقق من صحة هذه الأساليب ، فإن البيانات المأخوذة من الدراسات على الحيوانات تستخدم الجذعية المناعية فقط مشجعة.
مع التكنولوجيا الحالية ، قد لا يكون هناك إطلاق لقاح الأنفلونزا "واحد". وستكون المراقبة الوبائية ضرورية دائمًا. ومع ذلك ، ليس من غير المتصور أن نتمكن من الانتقال من نموذج مرة في السنة إلى منهج كل سنة 10 ، وقد نكون في غضون بضع سنوات من وجودنا هناك.
![]()
نبذة عن الكاتب
إيان سيتليف ، دكتوراه. طالب ، برنامج في البيولوجيا الكيميائية والفيزيائية ، مركز فاندربيلت للقاحات ، جامعة فاندربيلت وأمين مرجي ، دكتوراه. طالب ، قسم علم الأحياء الدقيقة والمناعة ، مركز Vanderbilt لقاح ، جامعة فاندربيلت
تم نشر هذه المقالة في الأصل المحادثة. إقرأ ال المقال الأصلي.
كتب ذات صلة:
at سوق InnerSelf و Amazon






















